Inaktivierte Ganzvirusimpfstoffe gegen COVID-19
Totimpfstoffe aus ganzen Viren: Wirkweise und Stand der Zulassungen
25.08.2022 – Inaktivierte Ganzvirusimpfstoffe gehören zu den traditionellen Impfstofftypen. Bereits im Frühjahr 2021 hat die Weltgesundheitsorganisation (WHO) zwei inaktivierten Ganzvirusimpfstoffen gegen COVID-19 eine Notfallzulassung erteilt. In der EU ist der Impfstoff von Valneva seit Juni 2022 zugelassen. Erfahren Sie hier, wie die Impfstoffe funktionieren und was ihre Vor- und Nachteile sind.
Inaktivierte Ganzvirusvakzine (Ganzvirusimpfstoffe) beruhen auf einer der traditionellen Impfstofftechnologien. Sie beinhalten nicht funktionsfähige Viren und gehören damit zu den sogenannten „Totimpfstoffen“ (siehe Box). Inaktivierte Ganzvirusvakzine kommen zum Beispiel bei den Impfungen gegen Polio, Hepatitis A oder Tollwut zum Einsatz. Zur Impfung gegen COVID-19 ist in der EU aktuell (Stand August 2022) das inaktivierte Ganzvirusvakzin des französischen Herstellers Valneva (VLA2001) zugelassen. Ein Vakzin des chinesischen Herstellers Sinovac Life Science (CoronaVac) befindet sich noch im Begutachtungsverfahren der Europäischen Arzneimittel-Agentur (EMA) [1].
|
Was sind Totimpfstoffe? Der Begriff „Totimpfstoff“ ist nicht klar definiert. Oft werden darunter alle Vakzine zusammengefasst, die auf nicht vermehrungsfähigen Erregern oder Erregerbestandteilen bestehen. Dazu gehören neben inaktivierten Ganzvirusimpfstoffen auch proteinbasierte Impfstoffe, mRNA-Impfstoffe und Vektorimpfstoffe. |
Notfallzulassung der WHO
Die Notfallzulassung bietet den WHO-Mitgliedern während des Gesundheitsnotstands eine Entscheidungshilfe bei der Medikamentenzulassung. Außerdem erlaubt es die Notfallzulassung UN-Organisationen, das Vakzin zu kaufen und z. B. an ärmere Länder weiterzugeben. Das bedeutet allerdings nicht, dass ein Vakzin in allen 194 Mitgliedsstaaten der WHO eingesetzt werden darf.
Bislang haben drei inaktivierte Ganzvirusvakzine im Rahmen der Corona-Pandemie eine Notfallzulassung der Weltgesundheitsorganisation (WHO) erhalten: Im Mai 2021 erteilte die WHO dem Vakzin des Herstellers Sinopharm (BBIBP-CorV) die Notfallzulassung, im Juni 2021 folgte das Sinovac-Vakzin (CoronaVac) und im November 2021 das indische Vakzin von Bharat Biotech (COVAXIN).
Der Sinovac-Impfstoff, der auch von der EMA begutachtet wird, verhindert symptomatische Infektionen bei Personen zwischen 18 und 59 Jahren mit bis zu 51 % Wirksamkeit, schwere Verläufe mit bis zu 100 % [2]. Zu Personen über 59 Jahren liegen bislang keine aussagekräftigen Daten vor. Die WHO empfiehlt den Impfstoff für Schwangere nur nach Risikoabwägung [2].
Wie funktionieren inaktivierte Ganzvirusvakzine?
Inaktivierte Ganzvirusvakzine beinhalten nicht funktionsfähige Viren, das heißt die Viren können sich nicht mehr vermehren und auch keine Erkrankungen auslösen. Dazu wird das Virus – in diesem Fall das Coronavirus SARS-CoV-2 – in einer Zellkultur produziert. Beim Sinovac-Vakzin besteht die Zellkultur aus sogenannten Vero-Zellen, die ursprünglich aus Affen stammen. Die so hergestellten Viren werden isoliert und mithilfe von Chemikalien (z. B. Formaldehyd) inaktiviert. Durch die chemische Inaktivierung wird sichergestellt, dass die Viren sich nicht im menschlichen Körper vermehren können. Durch bestimmte Reinigungsschritte werden unerwünschte Komponenten, z. B. Zellbestandteile, entfernt. Um die Wirkung des Impfstoffes zu verbessern, werden oft noch Adjuvanzien (Wirkungsverstärker) zugesetzt.
Bei der Impfung gelangen die inaktivierten Viren in den menschlichen Körper. Das Immunsystem erkennt sie als körperfremd und startet eine Immunantwort: Die verimpften Viren werden abgebaut. Danach besteht der Impfschutz durch Antikörper und sogenannte Gedächtniszellen weiter.
Impfreaktionen
Im Folgenden werden die Impfreaktionen dargestellt, die bei den Vakzinen von Valneva und Sinovac auftreten können. Die Impfreaktionen waren bei beiden Vakzinen meist mild.
Beim Valneva-Vakzin kam es bei mehr als 10 % der Patienten zu [3]:
- Kopfschmerzen
- Muskelschmerzen
- Reaktionen an der Einstichstelle, z. B. Empfindlichkeit oder Schmerzen
- Erschöpfung
- Übelkeit oder Erbrechen
Beim Sinovac-Vakzin kam es bei mehr als 10 % der Patienten zu [2]
- Kopfschmerzen
- Schmerzen an der Einstichstelle
- Erschöpfung
Inaktivierte Ganzvirusvakzine: Was spricht dafür, was dagegen?
Vorteile inaktivierter Ganzvirusvakzine:
- Der Körper bildet die Immunantwort gegen das komplette Virus aus, also gegen das Spike-Protein, das Membran-Protein, das Hüll-Protein und das Nukleokapsid-Protein (Abbildung 1). Die dadurch produzierten Antikörper und Immunzellen können dann auch SARS-CoV-2-Varianten mit verändertem Spike-Protein noch zuverlässig abwehren [4, 5].
- Die Vakzine können relativ einfach hergestellt, transportiert und gelagert werden [4, 5].
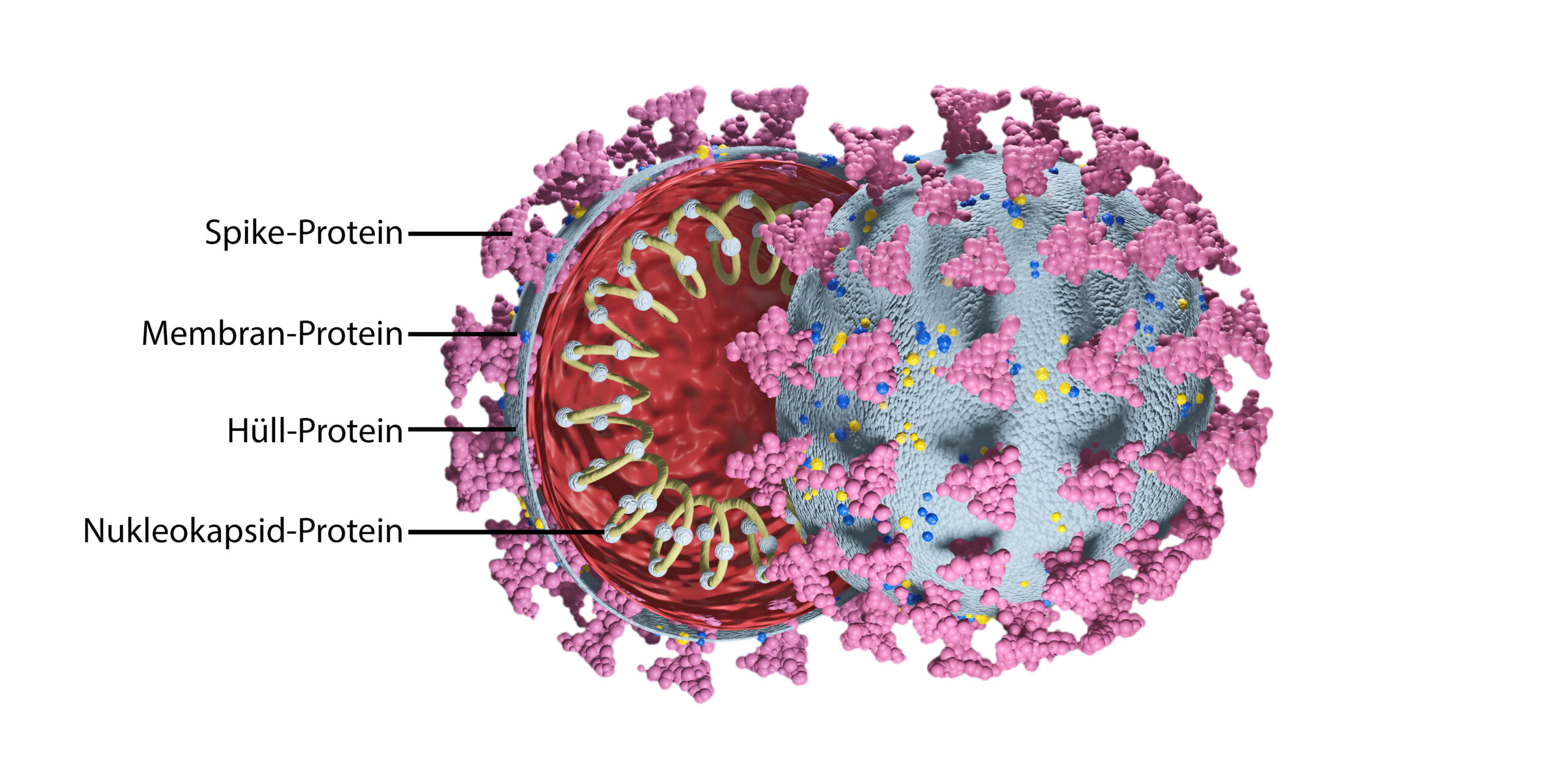
Abbildung 1: Aufbau des Coronavirus SARS-CoV-2.
Nachteile inaktivierter Ganzvirusvakzine:
- Sie können nur unter hohen Sicherheitsvorkehrungen produziert werden [5].
- Die Chemikalien, mit denen das Virus inaktiviert wird, können die Effektivität des Impfstoffs beeinträchtigen [4].
- Oft sind Adjuvanzien und mehrere Auffrischungsimpfungen nötig [4].
Quellen
- Europäische Arzneimittel-Agentur EMA. COVID-19 vaccines. In englischer Sprache verfügbar unter: https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/covid-19-vaccines; zuletzt abgerufen am 29. Juni 2022.
- World Health Organization. COVID-19 Vaccine Explainer: COVID-19 Vaccine (Vero Cell), Inactivated, CoronaVac®, Stand Juni 2021. Verfügbar unter: https://www.who.int/publications/m/item/sinovac-coronavac-vero-cell—inactivated-covid-19-vaccine; zuletzt abgerufen am 16. August 2021.
- Europäische Arzneimittel-Agentur EMA. COVID-19 Vaccine (inactivated, adjuvanted) Valneva (COVID-19 vaccine (inactivated, adjuvanted, adsorbed)). In englischer Sprache verfügbar unter: https://www.ema.europa.eu/documents/overview/covid-19-vaccine-inactivated-adjuvanted-valneva-epar-medicine-overview_en.pdf; zuletzt abgerufen am 29. Juni 2022.
- Kyriakidis NC, Lopez-Cortes A, Gonzalez EV et al. SARS-CoV-2 vaccines strategies: a comprehensive review of phase 3 candidates. NPJ Vaccines 2021; 6: 28
- Krammer F. SARS-CoV-2 vaccines in development. Nature 2020; 586: 516–527
Autorin des Beitrags: Dr. Christina Schüßler, medizinwelten-services GmbH, Stuttgart
Fachgebiet (Unterfachgebiet):
Allgemeinmedizin, Hals-Nasen-Ohrenheilkunde, Innere Medizin (Immunologie, Infektiologie, Pneumologie), Öffentliches Gesundheitswesen
Körperregion/Organsystem:
Immunsystem, Lunge
Jahreszeit:
ganzjährig
Anlass:
Pandemie, Impfung gegen Covid-19
Schlagwörter:
Adjuvans, BBIBP-CorV, CoronaVac, Coronavirus, COVAXIN, COVID-19, EMA, Europäische Arzneimittel-Agentur, European Medicines Agency, Hüll-Protein, Impfen, Impfung, Impfreaktionen, Impfstoff, inaktivierte Ganzvirusvakzine, Membran-Protein, Nukleokapsid-Protein, Pandemie, Protein, SARS-CoV-2, Sinopharm, Sinovac, Spike-Protein, Totimpfstoff, UN, Vakzin, United Nations, Vakzin, Valneva, VLA2001, Weltgesundheitsorganisation, WHO, Wirkungsverstärker, World Health Organization, Zellkultur